Forskarar ved MBI har løyst strukturen til et enzym involvert i cellas organisering

Main content
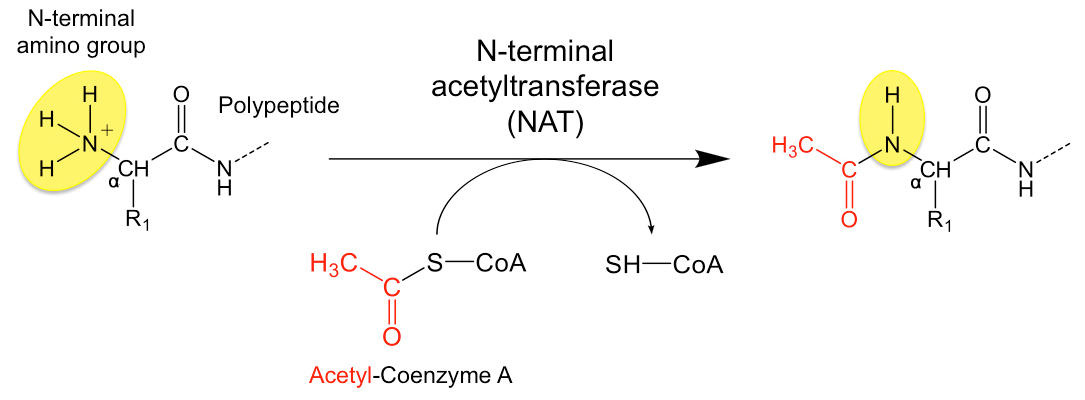
I siste utgåve av journalen Structure publiserer Svein Isungset Støve, Håvard Foyn og Thomas Arnesen frå NAT-gruppa ved Molekylærbiologisk institutt , i samarbeid med Bengt Erik Haug på Kjemisk institutt og forskarar ved University of Pennsylvania i USA, strukturen til den humane N-terminal acetyltransferasen (NAT) Naa60.
Naa60 er ein av seks forskjellige humane NATar som katalyserer N-terminal acetylering (Nt-acetylering), og har tidlegare vist seg å vera viktig for organiseringa av golgiapparatet i cellene og for prosessar involvert i celledeling. Golgiapparatet er ein organelle som finst i så godt som alle eukaryote celler og har som funksjon å organisere og klargjere protein som skal skiljast ut av cellene. Dersom ein tar ut Naa60 frå cellene endrar organiseringa av golgiapparatet karakter, mogelegvis som følgje av at eitt eller fleire av substrata til Naa60 ikkje vert Nt-acetylert. Ein annan studie har også vist at Naa60 er nødvendig for normal kromosomsegregering, ein viktig prosess som skjer tidleg i både meiotisk og mitotisk celledeling.
Strukturelle studiar avslørte unike eigenskapar med Naa60
- Naa60 har lenge vore eit stort mysterium for oss som forskar på NATar, men dei siste to-tre åra har me samla veldig mykje spennande data på dette enzymet seier Svein. I byrjinga av 2015 publiserte Henriette Aksnes og kollegaer frå NAT-gruppa og Prof. Ziegler si gruppe ved MBI eit banebrytande arbeid som mellom anna viste at Naa60 assosierer med golgi-membranar, og i all hovudsak Nt-acetylerer membranprotein som har N-terminalen på cytosolsk side av membranen. Det første me såg då me endeleg fekk ein krystallstruktur av Naa60 er at Naa60 har eit N-terminal acetyltransferasedomene som er strukturelt veldig likt acetyltransferasedomenet til Naa50, og at Naa60 mest sannsynlig består av eitt N-terminal acetyltransferasedomene og eitt domene som er nødvendig for membranassosiering.
–Me såg også at Naa60 har to unike forlenga loop-regionar som er involvert i binding av peptidsubstrat og i ein til no ukjent dimeriseringsmekanisme. For å studere korleis enzymet bind substrata i det aktive setet krystalliserte Svein og kollegaane ved UPenn Naa60 i kompleks med ein bisubstratanalog som har vorte utvikla i eit samarbeid mellom NAT-gruppa ved Mbi og Bengt Erik Haug på kjemisk institutt. Bisubstratanalogen består av acetyl-donoren CoA kovalent bunde til ei peptidkjede som representerer eit kjent Naa60 substrat.
Oppdaga ukjent dimeriseringsmekanisme
I eit forsøk på å krystallisere eit kompleks beståande av Naa60 saman med begge substrata (både acetyldonoren CoA og eit peptidsubstrat uavhengig av kvarandre) kom Svein og kollegaene over uventa data. – Då me løyste strukturen av det me trudde var Naa60 bunde til begge substrata kvar for seg viste det seg at berre eitt av substrata var til stades (acetyl donoren CoA) og at i staden for å binde peptidsubstratet hadde Naa60 molekyla dimerisert ved at ein loopregion frå kvar protomer skifta posisjon og direkte interagerte med kvarandre. Etter å ha studert ting litt nærare ser me også at Naa60 dimeriserer i løysing så det er ikkje ein krystalliseringsartifakt seier Svein. - Kor vidt denne dimeriseringa har noko relevans in vivo står att å sjå, men me forskar vidare på dette no, og kva me kjem fram til der kjem me ikkje til å avsløre heilt endå.
Svein Isungset Støve disputerte i 2015 for doktorgrada si ved Molekylærbiologisk Institutt i Bergen. Store delar av arbeidet med denne artikkelen blei utførd under eit forskaropphald ved Ronen Marmorstein sin lab ved Universitet i Pennsylvania, USA. Håvard Foyn er tilsett som postdoktor i Thomas Arnesens forskargruppe ved MBI og har syntetisert bisubstratanalogar i eit samarbeid med Bengt Erik Haug ved Kjemisk Institutt. Robert S Magin er PhD-student i Ronen Marmorsteins forskargruppe ved Universitetet i Pennsylvania. Prosjektet har vore støtta av Kreftforeningen, Helse Vest, BFS og NIH.