Setter brems på cellebevegelighet
Disse forskerne har gjort et oppsiktsvekkende funn innen cellebiologi. Adrian Drazic, Henriette Aksnes og Michaël Marie fra Thomas Arnesens gruppe fant et enzym som andre har lett etter i 30 år.
Without NAA80 the brakes are off
Hovedinnhold
Aktin er det proteinet det finnes mest av i cellene våre. For cellebiologer er studier av aktin viktig fordi det danner fibre som gir cellene form og struktur som gjør at de kan bevege seg.
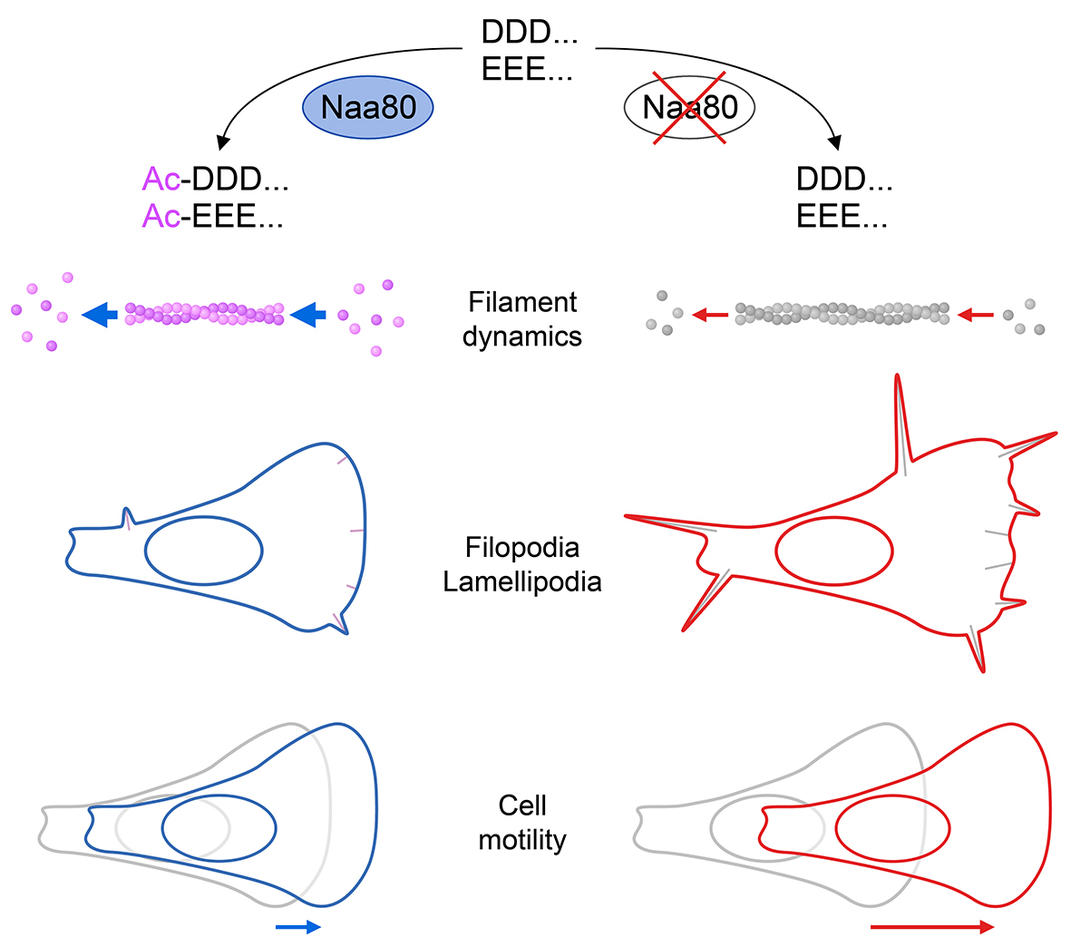
Forskere fra Bergen har nå funnet et enzym som utfører en liten - men viktig - endring av aktin: Det legger til en liten kjemisk gruppe til den ene enden av proteinet. Dette er en liten forandring, men det har stor innvirkning. Endring av proteinets kjemiske egenskaper innebærer også å forandre funksjonen av aktin, formen på cellene og deres evne til å bevege seg.
Enzymet heter NAA80, og det tilhører gruppen av N-terminal acetyltransferaser eller NATer. Dens jobb er å overføre en acetylgruppe til N-terminalen av et annet protein. Forskningsgruppen ledet av professor Thomas Arnesen fokuserer på disse enzymene, og de fant at NAA80 er annerledes.
Internasjonalt samarbeid
Det er en internasjonal trio av forskere fra Arnesens gruppe som har slått seg sammen for å fortelle denne historien. Biokjemiker Adrian Drazic, cellebiolog Henriette Aksnes, og mikroskopi-spesialist Michaël Marie lette ikke etter det de til slutt fant. Først lette de faktisk etter et annet enzym, men på veien fattet de interesse for NAA80 og dette viste seg å bli et interessant og verdifullt sidespor.
For å studere effekten av NAA80 på cellenes aktin strukturer brukte forskerne gen-saksen, CRISPR / Cas9, og kuttet NAA80 ut av genene til kreftcellelinjen HAP1. En analyse utført i samarbeid med Ghent Universitet i Belgia gav et klart og sterkt treff. NAA80 er en NAT med øye for kun et protein, aktin. Når celler mangler NAA80, har aktin ingen acetyl-gruppe på N-terminalen, og det betyr at NAA80 er det eneste enzymet som er ansvarlig for denne prosesseringen.
- Prosessering av aktin er ganske unik, forklarer Adrian Drazic.
- I begynnelsen kunne ikke forskerne helt forstå hvorfor det lille påhenget var viktig, og de kjente heller ikke de involverte enzymene. I lang tid ble det antatt at denne delen av aktin egentlig ikke er så viktig. Men nå fant vi ut at endringene som skjer her faktisk påvirker flere ting.
Fungerer som en brems – det sakker ned cellebevegelighet
Henriette Aksnes, som har skrevet sin doktorgradsavhandling om andre NAT-enzymer, ble overrasket da hun begynte å se på de NAA80-manglende cellene under et mikroskop.
- Disse cellene beveger seg faktisk raskere enn de andre.
Hun så dette i celle-motilitetsanalyser, en metode som måler hvor raskt celler beveger seg i en petriskål. Andre metoder kom til samme konklusjon. De NAA80-manglende cellene var alltid raskere. Fraværet av dette enzymet som endrer aktin, gjorde at celler beveger seg raskere enn normale celler.
- Dette betyr at acetyl-påhenget på aktin virker som en brems – det senker cellens bevegelighet, oppsummerer Aksnes.
Disse analysene viser at det er noe ekte og viktig med NAA80 og aktin, sier Marie.
- Og da jeg først begynte å jobbe med disse cellene ble det fort tydelig at det også var noen strukturelle forskjeller. De NAA80-manglende cellene hadde mye mer og lengre fingerlignende fremspring, filopodier.
Filopodier er aktinbaserte strukturer, viktige for cellebevegelse og kommunikasjon. De er veldig tett koblet til de underliggende aktinstrukturer. Som Marie sier:
- Så snart du tukter med cellens indre struktur vil du umiddelbart se en effekt. Og dette var veldig tydelig her.
Cellens indre aktinstruktur blir mer stabilt
Adrian Drazic, biokjemiker i laget, besøkte professor Roberto Dominguez ved University of Pennsylvania i Philadelphia for å lære topp moderne metoder innen aktinbiokjemi. Ved å bruke de NAA80-manglende cellene, renset de aktin. De testet deretter de biokjemiske egenskapene til denne spesielle aktin-formen, og sammenlignet den med aktin fra normale celler.
- Jeg gjorde disse biokjemiske analysene i Philadelphia, og vi så at det var store funksjonelle forskjeller. Det var da jeg skjønte at dette var veldig viktig.
Han målte en veldig spesiell egenskap av aktin, kalt polymerisering. Aktinproteiner kan feste seg sammen og danne lange stenger av proteiner, filamenter. Det gruppen fra Institutt for biomedisin sammen med Dominguez sin gruppe fant var at det lille påhenget på proteinets ende var ganske viktig for denne prosessen. Da det manglet, var både forlengelsen og depolymeriseringen mye langsommere enn normalt. Dette betyr at filamentene var mer stabile enn normalt. Denne økte stabiliteten er muligens grunnen til at disse cellene har en annen form og mer filopodia, og det er trolig også grunnen til at cellene kan bevege seg raskere.
Back-to-back publikasjoner
Funnene har vekket interesse i det internasjonale forskningsmiljøet. En doktorand, Marianne Goris, ble invitert til å studere NAA80s struktur i Marmorstein-gruppen ved University of Pennsylvania. Dette arbeidet resulterte i en annen artikkel publisert i samme utgave av tidsskriftet PNAS. Professor Arnesen og hans forskningsgruppe kan derfor skilte med to artikler i det berømte vitenskapelige tidsskriftet. De to artiklene er nå gitt ekstra oppmerksomhet i den siste utgaven av PNAS. http://www.pnas.org/content/115/17/4314
Rosinen i pølsa er den prestisjefylte tildelingen fra det Europeiske forskningsrådet ERC, som nylig ble tildelt Thomas Arnesen. Dette tilskuddet ble gitt slik at gruppen kan fortsette sitt arbeid med NAA80 og aktin, bruke nye modellsystemer og blant annet undersøke en mulig sammenheng med kreft og andre sykdommer.
Tilhørighet: Thomas Arnesen er gruppeleder ved Institutt for biomedisin og Institutt for biovitenskap ved Universitetet i Bergen. Han er også forsker ved Kirurgisk institutt på Haukeland Universitetssykehus. Adrian Drazic, Henriette Aksnes og Michael Marie er medlemmer av Arnesens gruppe ved Institutt for biomedisin og tidligere Institutt for molekylærbiologi.