Bruk av mikroskopi for å avdekke proteiners funksjon
I tidsskriftet Scientific Reports kan du denne måneden lese om ny forskning fra NAT-gruppen ved Molekylærbiologisk institutt (UiB). Forskerne mikroskoperte her levende gjærceller for å studere funksjonen til proteiner fra menneske. Vi mennesker har nemlig mye til felles med den lille bakegjæren, men betyr dette at gjær kan brukes i moderne medisinsk forskning for å studere oss selv?

Hovedinnhold
Scientific Reports 6, Article number: 31627 (2016), doi:10.1038/srep31627
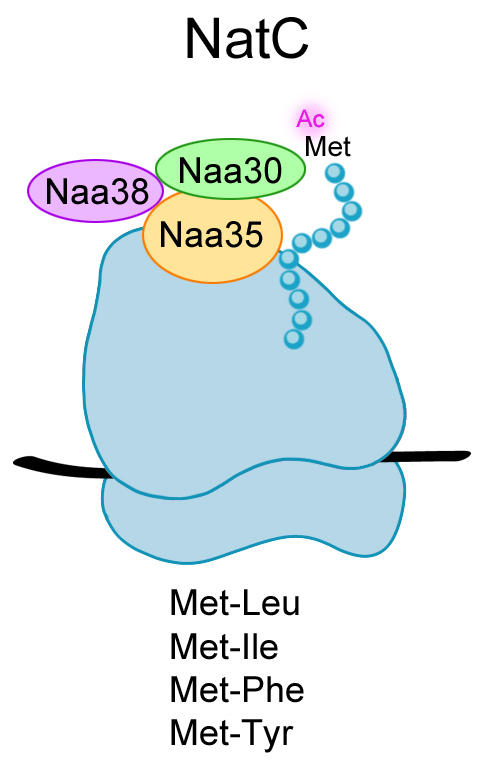
Hittil er det blitt oppdaget seks medlemmer av NAT-enzymfamilien i menneske (NatA-NatF) og fem av dem eksisterer også i gjærceller. Gjennom evolusjon har det det selvsagt oppstått ulikheter mellom enzymene, men den viktigst bevarte egenskapen er deres evne til å N-terminalt acetylere proteiner. Flesteparten av cellenes proteiner blir modifisert på denne måten, men hvorfor det skjer i så stor grad er fremdeles et mysterium.
I den aktuelle studien undersøkte Camilla Osberg og kollegaer om enzymkomplekset NatC fra menneske kan overføre acetylgrupper til N-terminalen (starten) av gjærproteiner in vivo. Arl3 er et kjent substrat av NatC og lokaliserer normalt til Golgi apparatet. I fravær av aktivt NatC, og dermed uten en N-terminal acetylgruppe, miss-lokaliseres Arl3 i cytosol. Dette skiftet i subcellulær lokalisering ble derfor brukt som modell for å se nærmere på hvilke kombinasjoner av NatC subenhetene, fra gjær og menneske, som fungerer sammen og gir aktivt NatC. For å kunne detektere Arl3 ved hjelp av fluorescensmikroskopi ble proteinet uttrykt med en GFP-tag koblet på C-terminalen (slutten). Figuren viser hvordan uttrykkingen av den katalytiske subenheten Naa30 fra det humane NatC kan gjenopprette normalt Arl3 lokaliseringsmønster i cellen.
Denne mikroskopimodellen er godt egnet til å studere diverse egenskaper hos NatC kompleksets komponenter. Dersom mutasjoner finnes hos pasienter kan modellen brukes til å definere om NatC subenhetene har normal funksjon eller om mutasjonene kan være årsak til sykdom hos mennesker.
Studien var en del av arbeidet som Camilla Osberg disputerte med i vår.
For mer informasjon om NAT enzymene og om arbeidet til gruppen, se hjemmesiden vår.