En «Jack of all Trades» i kreftceller
Kreft er en kompleks sykdom der en rekke faktorer er i ubalanse i cellene våre. NAA10 proteinet kan være en slik faktor. NAA10 utfører mange ulike oppgaver, hvor den mest vanlige er å katalysere acetylering av cellulære proteiner. NAA10 kan derfor sees på som et «Jack of all trades» protein. I to tiår har det blitt koblet til kreftutvikling, men nye funn setter dette enzymet på kreftkartet for alvor. NAA10 viser en overraskende variasjon i biokjemiske funksjoner som styrer mange signalveier i kreftceller og fremstår nå som en viktig regulator av både programmert celledød, autofagi og metastasering.

Hovedinnhold
Eksperimenter som ble utført for 20 år siden ved Haukeland Universitetssykehus avslørte et nytt gen som var oppregulert ved aggressiv skjoldbruskkjertelkreft (Fluge et al., Oncogene, 2002). Dette genet koder for NAA15 proteinet som da ble det første beskrevne medlemmet i en human enzymfamilie, protein N-terminal acetyltransferaser (NATs) (Arnesen et al., Biochem J, 2005). NAA15 danner sammen med NAA10 et kompleks som er viktig for kreftcellers overlevelse ved å forhindre programmert celledød (Arnesen et al., Oncogene, 2006). Dette komplekset acetylerer N-terminalen (den første aminosyren) til rundt 40% av alle humane proteiner (Arnesen et al., PNAS USA, 2009) og gir dermed en mulighet for proteinregulering.
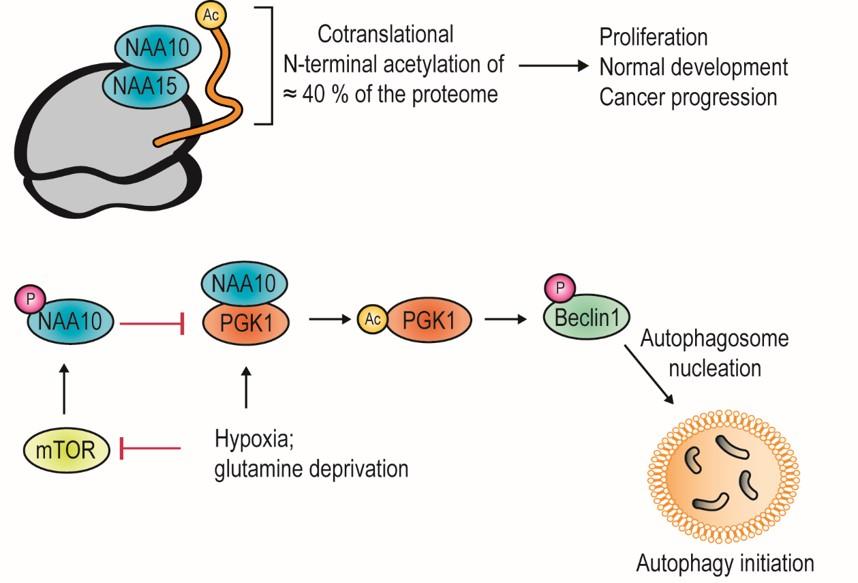
En lignende enzymfamilie, lysin acetyltransferaser (KATs), utfører en annen type protein acetylering, acetylering av lysin sidekjeder hos proteiner og er velkjent for sin påvirkning på genregulering og epigenetikk (histon acetylering). Tradisjonelt sett tenker vi at ett protein har en spesifikk rolle i cellene våre, men flere proteiner har vist seg å ha flere ulike funksjoner, såkalte moonlighting-proteiner. Når det gjelder protein acetylering virker NAA10 å være ganske unik ved å kunne acetylere lysin residuer (som en KAT) i tillegg til sin hovedfunksjon som en NAT avhengig av kontekst. På denne måten kan NAA10 acetylere og regulere ulike nøkkelproteiner i cellen. Disse funnene og den nyeste utviklingen i feltet er nå publisert av Henriette Aksnes, Rasmus Ree og Thomas Arnesen ved Institutt for Biomedisin, UiB (Aksnes et al., Mol Cell, 2019). For det første blir onkoproteinet Beta-catenin (Lim et al., Cancer Res, 2006) acetylert og aktivert av NAA10 noe som fører til økt celledeling. Et annet målprotein er den viktigste regulatoren for kreftcellers respons til lave oksygennivåer (hypoksi), transkripsjonsfaktoren Hypoxia inducible factor 1alpha (HIF-1α) (Kang et al., Redox Biol, 2018). Acetyleringen av HIF-1α gir degradering under normale oksygennivåer (normoksi). Et tredje målprotein er Heat shock protein 70 (Hsp70) som kan refolde proteiner etter kjemisk stress, og NAA10 acetyleringen av Hsp70 har en positiv effekt på denne aktiviteten (Seo et al., Nature Commun, 2016). Et fjerde målprotein er androgen reseptor (AR) og NAA10 mediert acetylering av AR aktiverer uttrykking av AR målgener ved prostatakreft (Wang et al., PNAS USA, 2012). Et siste eksempel er fosfoglycerat kinase 1 (PGK1). Ved normoksi blir NAA10 fosforylert av den berømte kinasen mammalian target of rapamycin (mTOR), som blokkerer interaksjonen mellom NAA10 og PGK1. Hypoksi eller glutamin mangel hemmer mTOR slik at NAA10 kan binde til og acetylere PGK1, som i neste omgang kan fosforylere Beclin1 slik at autofagosom kan dannes. NAA10 regulerer dermed tilgjengelighet av næringsstoffer og resirkulering av makromolekyler ved å indusere autofagi under hypoksi eller stress (Qian et al., Mol Cell, 2017). Dette er ofte kritiske prosesser for kreftceller.
Som om denne KAT/NAT-dobbeltfunksjonen ikke var nok så kontrollerer NAA10 også kreftceller uavhengig av sine acetyltransferaseaktiviteter. To av dens ikke-katalytiske interaksjoner påvirker det metastatiske potensialet hos kreftceller. I det første tilfellet kan NAA10 binde til STAT5a og dermed redusere uttrykkingen av STAT5a målgener slik som det prometastatiske ID1 (Zeng et al., Carcinogenesis, 2014). NAA10 kan også binde til PIX og dermed forstyrre PIX binding til GIT, noe som reduserer Cdc42 og Rac1 aktiviteten ved fokale adhesjoner og gir nedgang i cellens migrasjon (Hua et al., Mol Cell, 2011). I begge disse tilfellene har altså NAA10 en anti-metastatisk funksjon.
Så i primære kreftsvulster ligner NAA10 et onkoprotein som en acetyltransferase, men dens anti-metastatiske rolle som ikke-katalytisk regulator peker på at hemmere mot NAA10 sin acetyltransferase aktivitet som ikke påvirker de ikke-katalytiske egenskapene ville kunne være fordelaktige i kreftbehandling.
Hele artikkelen kan leses i siste utgave av Molecular Cell.