Mekanismen til en regulator av cellebevegelse
Aktin er det mest tilstedeværende proteinet i menneskeceller og er involvert i en rekke funksjoner inkludert styring av cellens arkitektur, cellebevegelse og celledeling. Nylig identifiserte UiB forskere NAA80 som en aktin regulator som lenge hadde vært ukjent. Nå avslører strukturen til NAA80 bundet til aktin og profilin hvordan denne regulatoren virker.

Hovedinnhold
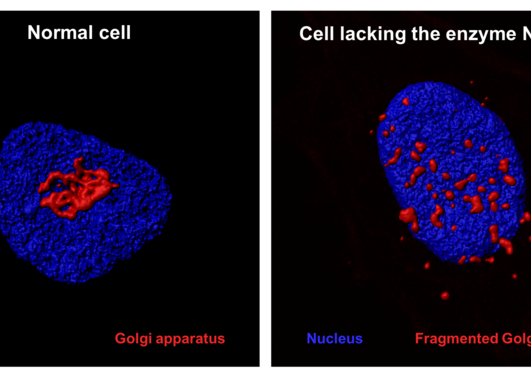
Aktin er en essensiell komponent av cytoskjelettet i menneskeceller og er involvert i en rekke funksjoner. I flere tiår visste man at aktins N-terminale ende ble kjemisk modifisert i celler av en acetylgruppe, men bare for to år siden ble aktins N-terminale acetyltransferase NAA80 identifisert av UiB forskere. NAA80 mediert N-terminal acetylering av aktin hadde en stor effekt på cytoskjelett dynamikk og cellebevegelse noe som understreker den biologiske betydningen av denne regulatoren.
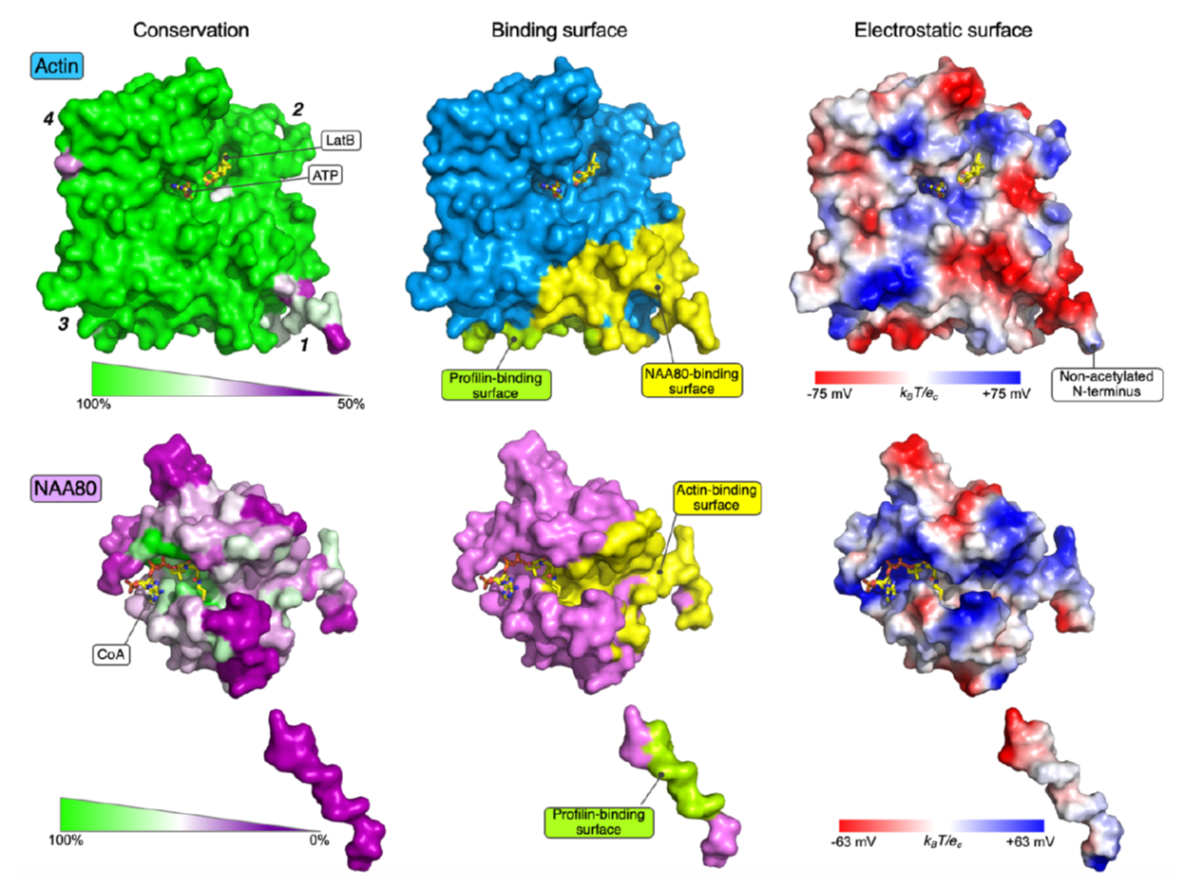
I menneskeceller er det et maskineri av syv N-terminale acetyltransferaser (NATs) som katalyserer N-terminal acetylering av totalt 80% av alle humane proteiner. De fleste NATs har derfor et stort antall substrater og mange arbeider på ribosomet for å utføre ko-translasjonell acetylering. På den annen side har aktin en dedikert NAT, NAA80, som jobber post-translasjonelt. Imidlertid mangler vi detaljert kunnskap om hvordan dette enzymet kan ha et unikt substrat som aktin. Aktins N-terminale ende er svært negativt ladd på grunn av flere sure aminosyrer og strukturen til NAA80 avslørte en katalytisk kløft som var dekket av positive ladninger som passet perfekt til denne negative delen av aktin. Men NAA80 må kunne skille aktin fra mange andre proteiner i cellen med tilsvarende sure N-terminale ender. Den sterke selektiviteten til NAA80 for aktin ble avdekket av in vitro bindindsforsøk som avslørte at aktin kunne danne svært sterke bindinger til NAA80 og dessuten at den kjente partneren til monomerisk aktin, profilin, var en mulig del av denne bindingen. Den trimeriske strukturen av aktin-NAA80-profilin ble løst i Dominguez laboratoriet ved University of Pennsylvania, og avslørte en omfattende bindingsoverflate mellom aktin og NAA80 og videre at det var direkte kontakt mellom NAA80 og profilin. Altså var det direkte fysisk kontakt mellom alle disse tre proteinene. Biokjemiske og molekylærbiologiske undersøkelser i Arnesen laboratoriet ved UiB ble utført av labmedlem Rasmus Ree, og alumni Adrian Draciz og Marianne Goris. Disse eksperimentene definerte at spesifikke interaksjoner mellom NAA80 og aktin/profilin var kritiske for cellulær aktin acetylering av NAA80. Disse nye dataene viser altså hvordan NAA80 kan virke unikt på aktin i cellene våre og representerer den første strukturen av en NAT bundet til sitt substrat.
Arnesen laboratoriet takker for støtte fra Helse Vest, Kreftforeningen, Forskningsrådet og det Europeiske forskningsrådet (ERC). Rasmus Ree har et postdoktorstipend finansiert av det medisinske fakultet ved UiB.