Cellulært GPS-system avslører nytt territorium for innflytelsesrik enzymfamilie
UiB-forskere har utviklet et ”GPS-system” for å finne proteiners posisjon i celler. Metoden er brukt til å avsløre en spesiell lokalisering for det nyeste medlemmet av en enzymfamilie med viktige oppgaver i menneskekroppen. Denne nye enzym-kunnskapen kan komme til nytte innen medisin og det cellulære ”GPS-systemet” vil kunne bli et nyttig verktøy i både grunnleggende biologisk og bioteknologisk forskning.

Hovedinnhold
NAT familien
N-terminal acetyltransferaser (NATer) er enzymer som gir en kjemisk endring i proteiner ved å sette på en acetylgruppe på den ene enden, kalt proteinets N-terminus. Denne prosessen kalles N-terminal acetylering og skjer med omlag 80% av de av cellens proteiner som finnes løselig i cytoplasma. Det er hittil identifisert seks medlemmer i NAT familien. Disse kalles NatA, NatB, NatC, NatD, NatE og NatF.
NATene har viktige oppgaver i cellene med betydning for vår fysiologi
Den fysiologiske betydningen av N-terminal acetylering er blitt åpenbar gjennom nylig oppdagede sykdommer som skyldes genetiske feil eller mangler i NAT enzymene. Men fremdeles vet man lite om hvordan NAT enzymene utfører disse oppgavene på molekylnivå. Thomas Arnesens forskningsgruppe (NAT gruppen) ved Molekylærbiologisk institutt har som mål å løse denne gåten. Forsker Henriette Aksnes og hennes kolleger i NAT gruppen har i en ny vitenskapelig publikasjon i tidsskriftet Cell Reports påvist at N-terminal acetylering skjer nesten like ofte med proteiner som sitter i membranene i cellens organeller og presenterer samtidig den første organelleassosierte NATen, NatF (også kalt Naa60).
NAT gruppen beskriver den første organelle NATen
Frem til nylig kjente man kun til cytosoliske NATer. Arnesens gruppe begynte å lete etter en organelleassosiert NAT for flere år siden. Etter å ha studert en rekke kandidater ved hjelp av avansert mikroskopi oppdaget de at NatF hadde et distinkt lokaliseringsmønster som var drastisk ulikt de fem andre NATene. Aksnes fikk oppgaven å karakterisere NatF som en del av sitt PhD-prosjekt. Hun disputerte i Februar 2014 og avhandlingen ble belønnet med fjorårets ZONA pris.
Samarbeid om ny protein-GPS i forskningsprogrammet ProtMetD
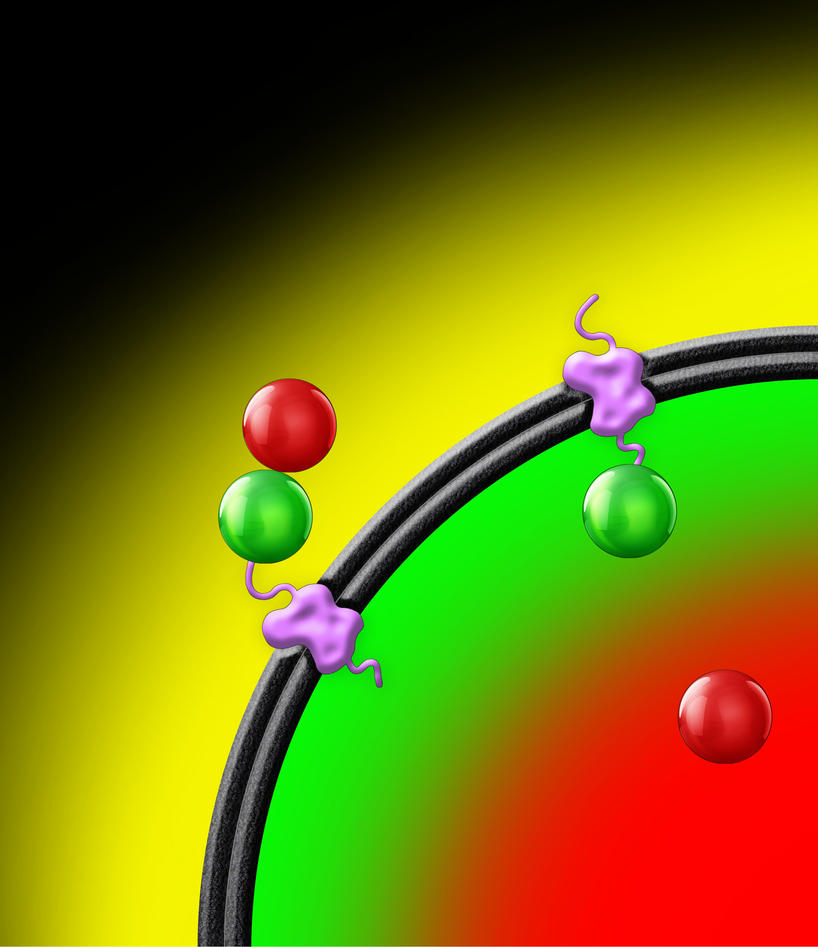
”NatF ble raskt mitt favorittprotein og jeg tilbrakte mange timer i mørket på mikroskoprommet der jeg studerte denne interessante og uvanlige NATen”, forteller Henriette. ”Så snart vi hadde oppdaget at NatF var den første membranassosierte NATen, begynte vi å lure på om den arbeidet inni organellen eller mot cellens cytosol”. Flere mikroskopibaserte studier, inkludert en nyutviklet metode kalt PROMPT (PROtease assay for Membrane Protein Topology), viste at NatF befant seg på den cytosoliske siden av de intracellulære membranene. ”Denne metoden er utviklet av Marc Niere og kolleger i Mathias Zieglers forskningsgruppe, og et produktivt samarbeid ble initiert i forskningsprogrammet ProtMetD da vi forstod at de trengte et ukarakterisert protein til å demonstrere PROMPT metodologien”. Denne metoden kan brukes både som et posisjoneringssystem og som et GPS-sporingssystem for proteiner inne i en celle. I motsetning til mer konvensjonelle metoder som kan fortelle hvor i cellen et protein er, så kan PROMPT også si noe om hvor det har vært. PROMPT er en videreutvikling av en metode som tok form ved MBI for vel 10 år siden.
NatF foretrekker transmembrane proteiner
De ulike medlemmene i NAT familien skiller seg fra hverandre ved at de har ulik substratspesifitet, det vil si at de gjenkjenner og acetylerer ulike proteiner basert på aminosyresekvensen i de N-terminale endene av proteinene. I samarbeid med Petra Van Damme og Kris Gevaert ved VIB (Vlaams Instituut voor Biotechnologie, Ghent) bruker vi en avansert metode, kalt COFRADIC, for å identifisere NATenes substrater. Metoden har tidligere vært benyttet til å bestemme substratspesifiteten til de andre NAT enzymene. Det unike med analysen av NatF var at kun transmembrane proteiner, altså de som sitter fast i cellemembranene, ble plukket opp. Med disse resultatene ble det vist at N-terminal acetylering er vanlig ikke bare blant cytoplasmiske proteiner, men også blant membranbundne proteiner.
Videre arbeid: NatF holder Golgiapparatet sammen, men hvordan?
”I tillegg til å være lokalisert til Golgiapparatet antyder også funnene våre at NatF har en funksjon for opprettholdelse av Golgi apparatet sin struktur. Golgi er den organellen som forbereder og dirigerer proteiner som skal skilles ut av cellene. Ved å hemme uttrykkingen av NatF, observerte vi at Golgi ble fragmentert. Vi tror at dette skyldes manglende N-terminal acetylering av et eller flere proteiner som er betydningsfulle for Golgi.” Henriette ser frem til å gå dypere inn i NatF sine cellulære funksjoner sammen med medforfatterne PhD-student Marianne Goris og forsker Michaël Marie som har en spesiell interesse og erfaring med Golgi. ”Etter hvert som bitene kommer på plass håper vi å komme nærmere en forklaring på hvorfor NAT enzymene er så viktige for både celler og organismenes fysiologi. Vi vet allerede at NatF er regulert og har en mulig rolle ved minst to ulike sykdommer og dette følges opp i videre studier.”
Studien er publisert i det vitenskapelige tidsskriftet Cell Reports 26. Februar 2015.
NAT gruppens forskning mottar støtte fra Bergens Forskningsstiftelse, Norges Forskningsråd, Kreftforeningen, og Helse Vest.