Fra prosjektoppgave i MOL231 til publikasjon
Ine og Emilie skulle ha en liten prosjektoppgave i molekylærbiologi. De endte opp med å utvikle en metode for å kvalitetssikre en cellemodell som brukes av tusenvis av forskere verden over.

Main content
Gjennom kurset Prosjektoppgave i molekylærbiologi (MOL231) var vi heldige å få være med på prosessen med å finjustere og dokumentere en metode for å kvalitetssikre den populære, CRISPR/Cas9-vennlige cellelinjen HAP1. Sammen med våre veiledere Henriette Aksnes og Tobias B. Beigl, har vi nylig publisert en artikkel hvor vi demonstrerer hvordan den ustabile ploiditeten til HAP1 påvirker flere av cellens egenskaper. Vi presenterer en effektiv løsning på problemet, og hvordan man slik unngår at forskjell i ploiditet blir en forstyrrende variabel i eksperimenter.
HAP1 celler kan endre ploiditet
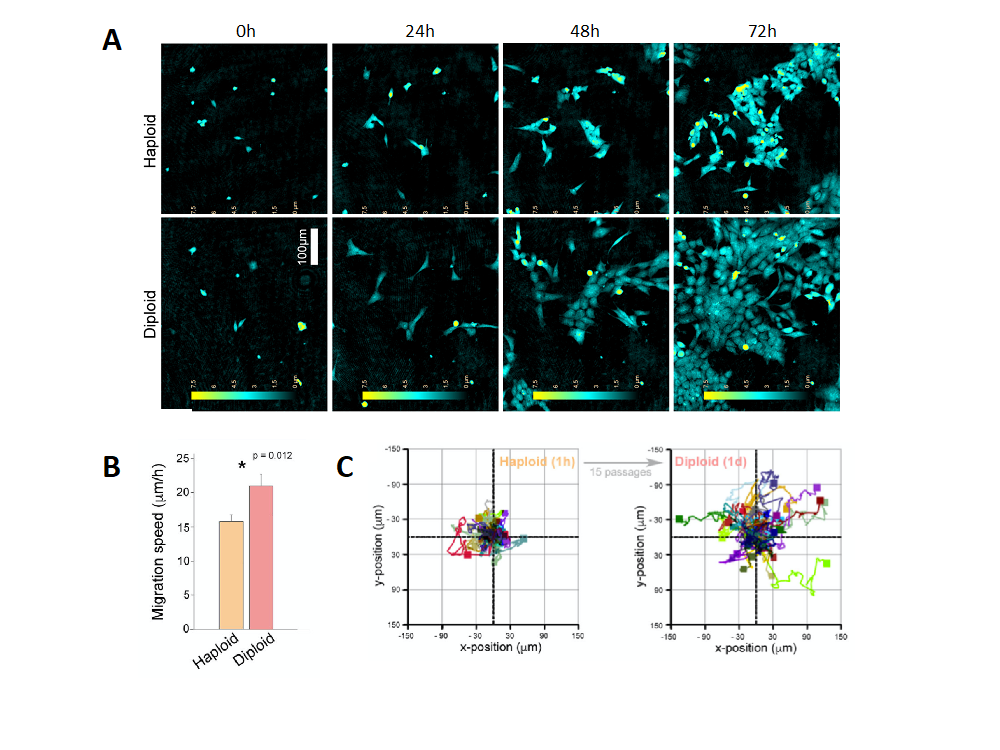
I motsetning til diploide celler, som har kromosompar bestående av en kopi fra hver forelder, har haploide celler, slik som HAP1, kun en enkelt kopi. Dette er en fordel når man skal bruke CRISPR/Cas9 til å produsere genetiske mutanter fordi CRISPR/Cas9 maskineriet da bare trenger å redigere ett allel. Da veilederen vår Henriette Aksnes begynte å jobbe med forskjellige HAP1 knockouts la hun merke til at den haploide tilstanden til HAP1 var ustabil, og at cellene spontant ble diploide over tid. Videre undersøkelser, med blant annet HoloMonitor M4 mikroskop, viste at det fantes flere grunnleggende forskjeller mellom haploide og diploide HAP1 celler. For eksempel forskjeller i cellestørrelse, cellebevegelse og konfluens (Figur 1).
Dette gjorde at vi, sammen med veiledere Henriette og Tobias, startet å arbeide med å utvikle en protokoll for å kultivere og kontrollere HAP1 celler frem til de nådde den diploide tilstanden. Vi bestemte ploiditet ved hjelp av flow cytometri. Senere i prosjektet demonstrerte vi også at diploide celler effektivt kan sorteres ut fra kulturer av lav passasje, slik at man kan spare både tid og penger på cellekulturarbeid.
Kontroll av HAP1 ploiditet ved hjelp av flow cytometri
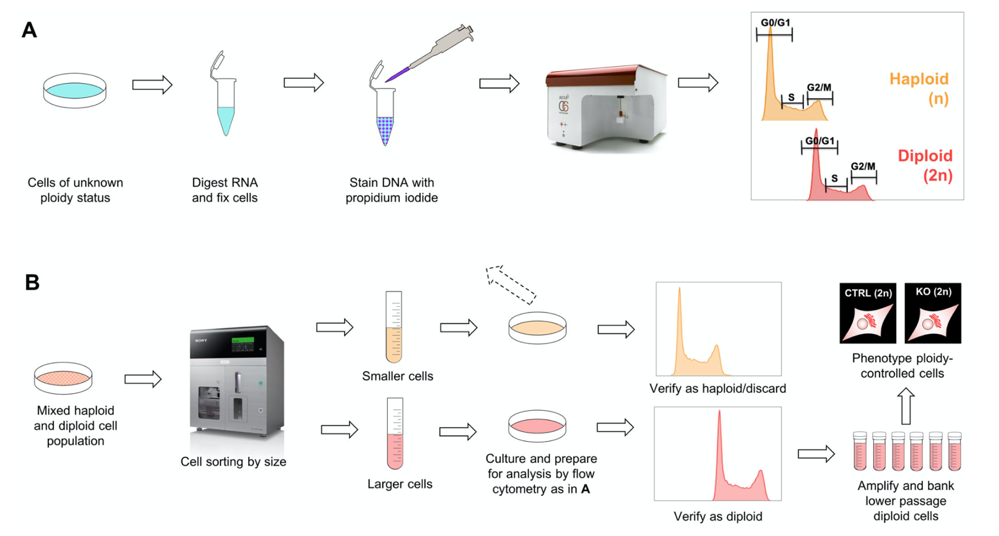
For å kontrollere ploiditeten brukte vi en allerede etablert metode der DNAet i cellene farges med propidiumjodid (PI). Videre ble mengden DNA målt med flow cytometri. Vi kontrollerte flere knockout-cellelinjer av forskjellige passasjenummer og kunne konstatere at cellene begynte å bli diploide allerede ved passasje 10, og at man nådde en ren diploid kultur ved passasje 20-30.
Diploide celler kan sorteres ut fra kultur ved hjelp av størrelsesbasert sortering
Vi ønsket å teste om det var mulig å fremskynde diploidiseringsprosessen ved å sortere ut diploide celler fra en blandingskultur av lav passasje. Fordi diploide HAP1 celler er fysisk større enn haploide HAP1 celler, brukte vi en størrelsesbasert sorteringsmetode i et Sony SH800 flow cytometer. Vi kontrollerte deretter ploiditeten til de utsortere populasjonene og kunne fastslå at rene diploide kulturer var mulig å oppnå ved passasje 18, og muligens tidligere, ved hjelp av denne strategien. Protokollen vår er oppsummert i Figur. 2.
Laveregradsstudenter kan også bidra til forskning!
Gjennom den kombinerte innsatsen til studenter og forskere klarte vi målet vårt, og den effektive løsningen vår for å takle HAP1 cellers ustabilitet er nå publisert i Biology Open (Beigl, Kjosås, Seljeseth, Glomnes & Aksnes, 2020). De fleste universiteter er fylt med unge, motiverte studenter, men fåtallet av laveregradsstudenter får muligheten følge et ekte forskningsprosjekt, og arbeide målrettet mot å publisere arbeidet sitt. Fordi laveregradsstudenter ofte mangler erfaring og kunnskap, synes mange forskningsgrupper at det blir for tidkrevende å ta de inn i laboratoriet. Likevel, ettersom studentene får mer erfaring kan de være med på å sette inn et ekstra gir for prosjektet, komme med nye perspektiver og stille spørsmål som veilederne kanskje ikke har tenkt på.
Gjennom deltagelsen i MOL231 fikk vi muligheten til å følge et forskningsprosjekt på nært hold. Vi fikk verdifull praktisk erfaring med cellekultur, flow cytometri og holografisk mikroskopering, og ikke minst lærte vi hvor viktig det er å kvalitetssikre cellelinjer. Vi er veldig takknemlige for at Arnesen laben og teamet ledet av Henriette Aksnes investerte tiden som trengtes for å lære oss opp. Det var inspirerende å få lov å være med i et så profesjonelt og inkluderende arbeidsmiljø.