Nye molekylære innsikter i tidlig proteinmodning
Proteiner er cellenes nøkkelarbeidere, og mange av dem gjennomgår en modningsprosess når de lages for å oppnå riktig funksjon. NatA er en viktig aktør i denne prosessen og er et enzymkompleks som modifiserer proteiner etter hvert som de blir laget.

Main content
Ny forskning viser nå at NatA er mer enn bare et modifiserende enzym, det kan fungere som et sentralt knutepunkt som koordinerer flere faktorer i de tidligste trinnene av proteinmodning.
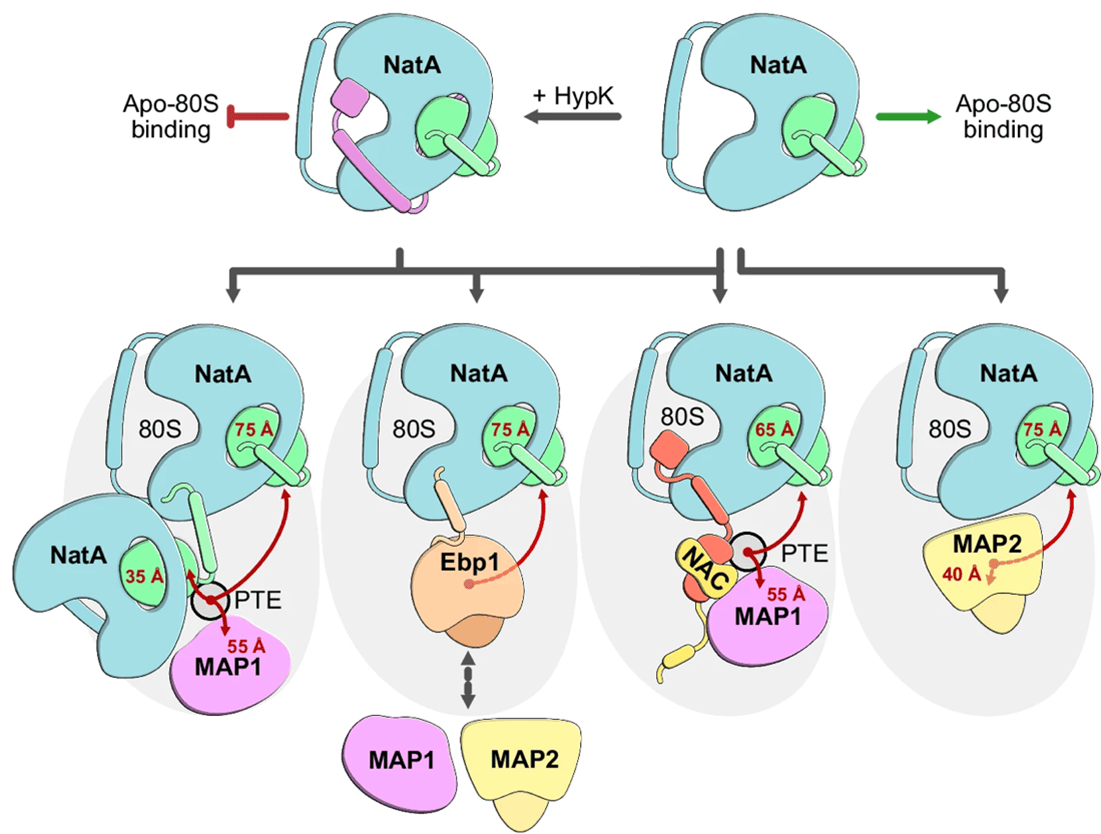
En av de vanligste proteinmodifikasjonene er N‑terminal (Nt) acetylering, som påvirker stabiliteten og funksjonen til proteiner ved å feste en acetylgruppe på deres N-terminale ende. Et enzymkompleks kalt NatA er ansvarlig for Nt‑acetylering av rundt 40 % av alle humane proteiner. NatA består av to kjernekomponenter: den katalytiske subenheten NAA10 og den ribosom-bindende subenheten NAA15. I tillegg samarbeider NatA med andre proteiner på ribosomet for å sikre korrekt modning av nydannede proteiner. Nyere forskning har vist at NatA danner et multienzymkompleks med nascent‑polypeptid assosiert kompleks (NAC) og/eller de N‑terminale metioninfjerningsenzymene MetAP1 og MetAP2. MetAP-enzymene fjerner først initiatormetioninet fra en nydannet polypeptidkjede dersom den andre aminosyren i rekken er alanin, serin, valin, glysin, treonin eller cystein, før NatA deretter fester en acetylgruppe på proteinets N‑terminal.
I en nylig publisert studie oppdaget forskere fra professor Irmgard Sinnings laboratorium (Heidelberg University Biochemistry Center) at NatA er mer allsidig enn man tidligere har antatt. In vitro bindingsanalyser viste at NatA også kan danne komplekser med flere ribosomassosierte faktorer uavhengig av ribosomer. Strukturelle data viste at NatA kan danne et treparts-kompleks med et pseudoenzym kalt Ebp1 på ribosomet, eller til og med rekruttere et annet NatA-kompleks fra en annen posisjon nær ribosomets polypeptidtunnel, noe som potensielt kan gi lettere tilgang til substratene det skal modifisere. Forskergruppen identifiserte også et konservert bindingssete i NAA15 som fungerer som en slags dokkingsstasjon for flere partnere, inkludert Ebp1, NAC, NAA10 og HYPK. Disse interaksjonene gjør det mulig for NatA å sette sammen ulike multifaktor-komplekser ved utgangen av ribosomets polypeptidtunnel. Postdoktor Nina McTiernan i Thomas Arnesens gruppe (Institutt for biomedisin, UiB) bidro med cellebaserte eksperimenter som bekreftet disse NatA‑interaksjonene.
Oppsummert viser denne studien at NatA ikke bare katalyserer Nt‑acetylering på ribosomet, men også fungerer som et interaksjonsknutepunkt som koordinerer de tidlige trinnene i proteinmodning. Innsikt i disse interaksjonene er avgjørende for å forstå hvordan celler opprettholder og kontrollerer proteinkvalitet.
Den publiserte artikkelen finner man her:
NatA engages in multi-factor complexes at the ribosomal polypeptide tunnel exit | Nature Communications