Struktur av et enzymkompleks som er oppregulert i kreftceller
I humane celler er N-terminal acetylering blant de vanligste proteinmodifiseringene. Nå har forskere ved Universitetet i Pennsylvania og Universitetet i Bergen avslørt de strukturelle og biokjemiske egenskapene til den viktigste molekylære maskinen som er involvert i denne prosessen. Dette enzymet er helt nødvendig for at kreftceller skal overleve og dele seg.

Main content
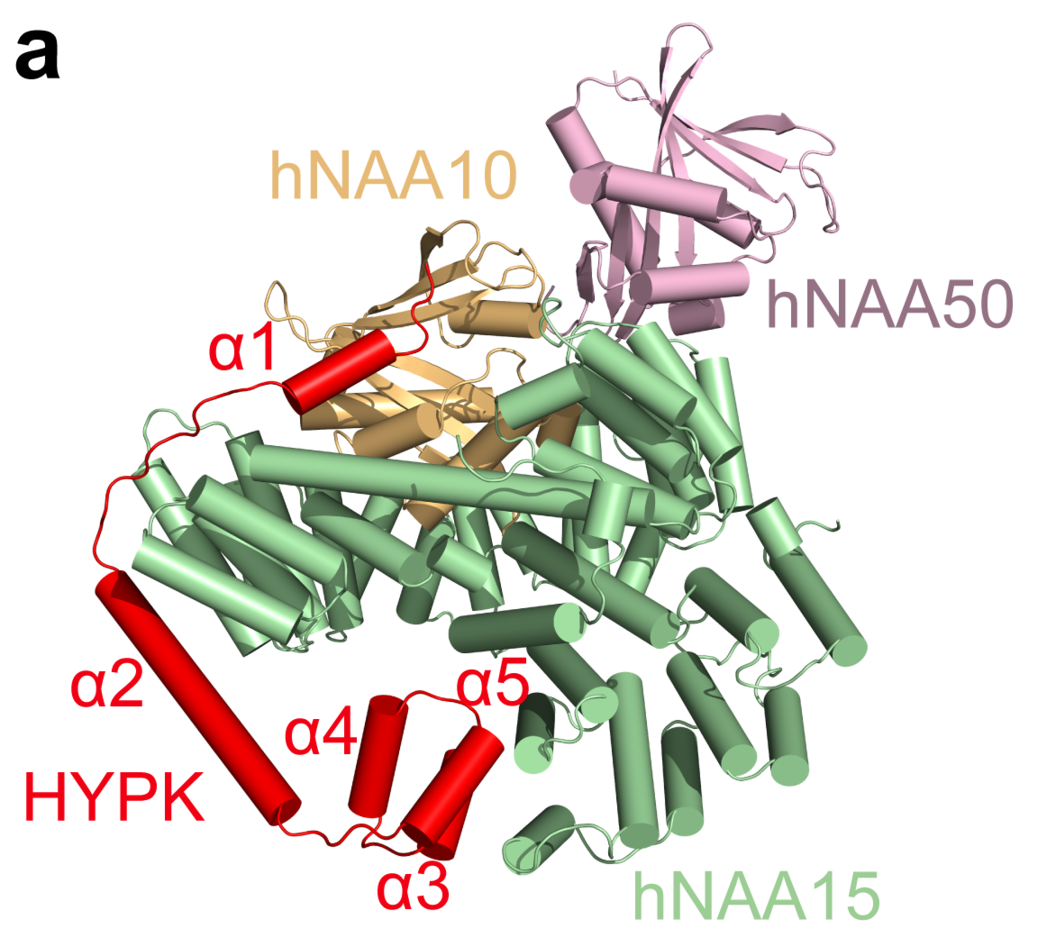
Omtrent halvparten av alle N-terminale acetyleringer som skjer i menneskeceller katalyseres av et enzymkompleks som kalles N-terminal acetyltransferase A (NatA). Opprinnelig funnet oppregulert i skjoldbruskkjertelkreft av UiB forskere for tjue år siden og biokjemisk definert for 15 år siden, er den molekylære forståelsen av dette enzymet nå nesten komplett. Forskningsgrupper ved Universitetet i Pennsylvania og Universitetet i Bergen løste strukturen og de biokjemiske egenskapene til det humane tetramer-komplekset NAA15-NAA10-NAA50-HYPK. NAA15 fungerer som et anker på ribosomet og setter de to katalytiske subenhetene NAA10 og NAA50 i passende posisjoner for å utføre N-terminal acetylering av nye polypeptider som kommer ut av ribosomet. HYPK reduserer på den andre siden den katalytiske reaksjonen, sannsynligvis som en kvalitetskontroll av acetyleringsprosessen. Professor Ronen Marmorsteins lab ved UPenn i Philadelphia løste strukturen til dette holoenzymet med cryo-EM som gir en oppløsning ned til nær atomnivå av alle subenhetene. I Bergen, utførte Ph.D. kandidat Nina McTiernan i Arnesen lab ved Institutt for Biomedisin aktivitetsmålinger av ulike designede enzymkomplekser i humane celler for å forstå bidraget til de ulike subenhetene.
NAA15-NAA10-NAA50-HYPK komplekset utfører ko-translasjonell acetylering av nye polypeptider som enten har initiator Metionin intakt (aktivitet kalt NatE – reaksjon katalysert av NAA50) eller initiator Metionin kløyvet (aktivitet kalt NatA – reaksjon katalysert av NAA10), som til sammen utgjør det største antallet substrater blant alle NAT enzymer. Siden dette komplekset eller dets subenheter er funksjonelt endret eller regulert i mange sykdomstilstander inkludert ulike typer kreft (se review) gir disse studiene et viktig innblikk i den molekylære basis for utvikling av terapeutiske drugs.
Les hele artikkelen her.
Arnesen laboratoriet takker for støtte fra Helse Vest, Kreftforeningen, Norges Forskningsråd, Det Europeiske Forskningsråd (ERC). Nina McTiernan er Ph.D. kandidat finansiert av det Medisinske Fakultet UiB. Deler av arbeidet ble utført ved Proteomikkenheten ved Universitetet i Bergen (PROBE).