Funn av genmutasjoner som gir medfødt hjertefeil
Hvert år fødes det omlag 600 barn med medfødt hjertefeil i Norge Vi vet fortsatt lite om årsakene til at barn utvikler medfødt hjertefeil. En ny internasjonal studie hvor blant annet forskere fra Universitetet i Bergen og Haukeland Universitetssykehus har vært involvert viser at NAA15-proteinet kan inneha en viktig rolle.

Main content
Hjertefeil rammer omtrent 1% av alle nyfødte og er den vanligste medfødte misdannelsen. Det vil si at det fødes omlag 600 barn med medfødt hjertefeil i Norge hvert år. Medfødt hjertesykdom gjenspeiler feil i hjertets utviklingsprogram, som leder til misdannelser i hjertet eller de store blodårene som omgir hjertet. I de fleste tilfeller er det ingen åpenbar årsak til hjertefeilene, men antakeligvis spiller både arv og miljø inn. Å definere de genetiske årsakene til medfødt hjertefeil vil gi ny innsikt i mekanismer for hjerteutvikling, som til slutt kan være til nytte for pasienter med medfødt hjertefeil og deres familier.
Defekt NatA enzym kan føre til utviklingsfeil
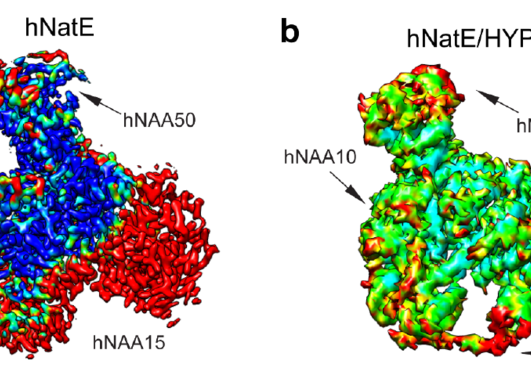
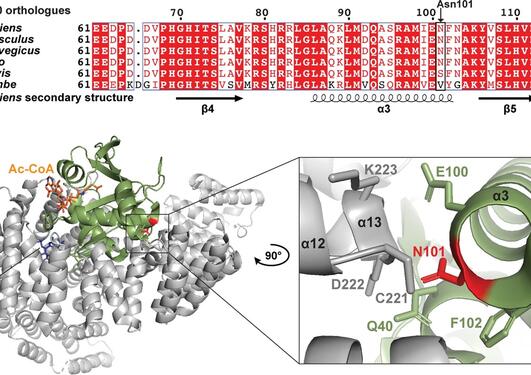
Genetiske studier har vist at genfeil i NAA15 kan utgjøre en risiko for medfødt hjertefeil. NAA15 genet koder for det ribosomale ankerfestet til et enzymkompleks kalt NatA. NatA katalyserer overføringen av en acetylgruppe fra acetyl-koenzym A til starten av et protein, en prosess som kalles for N-terminal acetylering. Acetylering av proteiner er svært vanlig og det anslås at 85% av proteinene våre er i varierende grad acetylert på N-terminusen. Konsekvensene av N-terminal acetylering er forskjellig, og inkluderer endringer i proteinstabilitet, kompleksdannelse, proteinfolding- og aggregering. En defekt i NatA komplekset kan føre til redusert N-terminal acetylering. Dette kan ramme utviklingen av hjertet og sentralnervesystemet, noe som gir et bredt spekter av medfødte hjertefeil og nevrologiske symptomer.
NAA15 et risikogen for medfødt hjertefeil
I en ny internasjonal studie, publisert i det medisinske tidsskriftet Circulation Research, har forskere sett på forholdet mellom N-terminal acetylering, NAA15 og medfødt hjertefeil (Figur 1). Ved å studere arvematerialet til 4511 pasienter med medfødt hjertefeil i USA fant forskere ved Harvard Universitet fire individer med en sjelden tap av funksjon variant av NAA15 genet. Videre undersøkelser av disse sjeldne NAA15 variantene i gnomAD, som er en populasjonsfrekvensdatabase hvor man har samlet eksom-og genomsekvenseringsdata fra en rekke store sekvenseringsprosjekter, støttet mistanken om at disse variantene øker risikoen for medført hjertefeil. Studien som er ledet av forskere ved Seidman laboratoriet ved Harvard Medical School identifiserte også 16 sjeldne NAA15 missense varianter som vil gi en feil i aminosyresekvensen til genproduktet.
Gjær kan brukes til å studere menneskelig sykdom
Gjær kan brukes som modellorganisme for å studere funksjonen til gener som er involvert i menneskelig sykdom. Når gjærceller mangler NatA komplekset vokser de senere enn normale celler og de blir svært sensitive for miljøforandringer, som for eksempel forhøyet temperatur. Molekylærbiolog Sylvia Varland har designet gjærceller som utrykker det humane NatA komplekset med forskjellige varianter av NAA15.
- Veksten til disse designer gjærcellene ved forhøyet temperatur kan gi oss en pekepinn på hvor funksjonelt det aktuelle NatA komplekset, sier Sylvia Varland som er forsker ved Institutt for Biomedisin ved Universitetet i Bergen.
De to NAA15 variantene D335fs og S761* var ikke i stand til å redde den temperatursensitive vekstfenotypen til gjærceller som manglet NatA komplekset (Figur 2). Dette stemmer overens med at disse variantene antas å gi tap av funksjon. NAA15 R276W varianten klarte derimot å redde gjærveksten, noe som tyder på en delvis NatA-funksjon i gjær.
Utvikling av NAA15 stamcellemodell ved bruk av CRISPR
Cellene våre har to sett med gener, ett fra mor og ett fra far. Dersom et gen inaktiveres, for eksempel ved at det oppstår en tap av funksjon mutasjon, eller slettes kan det hende at den gjenværende funksjonelle genvarianten ikke er tilstrekkelig for å produsere det nødvendige genproduktet for å sikre normal funksjon. Dette fenomenet kalles på engelsk for «haploinsufficiency» (haplo = en, insufficiency = mangel på).
Pluripotente stamceller er ikke-spesialiserte celler som kan bli til en hvilken som helst celletype i kroppen, for eksempel hjertemuskelceller (kardiomyocytter). Hva skjer dersom man påvirker proteinnivået av NAA15, vil stamcellene fremdeles kunne utvikle seg til hjerteceller og vil de fungere normalt? I denne studien introduserte forskerne NAA15 genvarianter i induserte pluripotente stamceller (iPS-celler) ved hjelp av genredigeringsverktøyet CRISPR/Cas9. Dette resulterte i iPS celler som enten manglet (NAA15-/-) eller hadde redusert nivå av NAA15 proteinet (NAA15+/- og NAA15 +/R276W). Ved å tilsette en cocktail av ulike kjemikalier og vekstfaktorer kan iPS celler utvikle seg til å bli hjertemuskelceller. iPS cellene som manglet NAA15 vokste veldig sent og lot seg ikke differensiere til hjerteceller. Stamceller som kun uttrykket en normal kopi av NAA15 genet utviklet seg til hjertemuskelceller (NAA15+/- og NAA15 +/R276W), men de hadde ikke samme evne til å trekke seg sammen (kontraksjon) som celler med normale nivåer av NAA15 proteinet (NAA15+/+).
- Denne studien viser at nivået av NAA15 og dermed trolig nivået av NatA mediert N-terminal acetylering av proteiner er essensielt både for normal differensiering til hjerteceller og for at disse hjertecellene skal ha normal funksjon, sier Thomas Arnesen som er Professor ved Universitetet i Bergen og forskningsleder ved Institutt for Biomedisin og Kirurgisk klinikk, Haukeland Universitetssykehus.
Ribosomal proteinmangel på grunn av redusert nivå av NAA15
NAA15 er en del av enzymkomplekset NatA, som utfører N-terminal acetylering i forbindelse med proteinsyntese. Gevaert laboratoriet ved VIB-UGent utførte proteomikkanalyser for å vurdere acetyleringsnivået i disse cellene. Kun noen få NatA substrater var mindre acetylert i iPS celler som ikke uttrykket NAA15. Det var derimot en klar forskjell i det generelle proteinnivået mellom normale og NAA15 muterte celler. Totalt var 562 proteiner differensielt uttrykket i celler som manglet eller hadde redusert nivå av NAA15 sammenlignet med normale celler.
- Disse funnene tyder på at NAA15 og NatA komplekset har en viktig rolle i proteinsyntese og/eller proteinstabilitet», forteller Sylvia Varland.
NAA15 ankrer NatA komplekset til ribosomene, som er molekylære maskiner som utfører proteinsyntese. Mangel på NAA15 førte til reduserte nivå av flere ribosomale proteiner, særlig de som var lokalisert i nærheten av det ribosomale ankerfestet til NAA15. Bindingen av NAA15 til en eller flere av disse proteinene beskytter dem antakeligvis fra nedbryting enten i forbindelse med oppføringen av ribosomene eller påfølgende ribosomal aktivitet. Dette tyder på at mangel eller fravær av NAA15 kan føre til ribosomal proteinmangel, enten som følge av den manglende bindingen til ribosomale proteiner eller på grunn av den reduserte graden av N-terminal acetylering av proteiner. Når ribosomene ikke fungerer optimalt kan proteinproduksjonen bli innskrenket, noe som kan medføre alvorlige konsekvenser for normal celleutvikling.
Arnesen laboratoriet mottar støtte fra Norges forskningsråd (NFR), Helse Vest, og Kreftforeningen. Sylvia Varland mottok et mobilitetsstipend fra NFR, som ble samfinansiert av EU. Deler av arbeidet ble utført ved Donnelly Center for Cellular & Biomolecular Research, Toronto, Canada i forbindelse med utlandsoppholdet.